- HOME
- 医療機器の開発・製造に求められる認証とは
設計 医療機器ODM
医療機器の開発・製造に求められる認証とは
あらゆる製品が市場に導入される際には、その安全性と有効性が確保されるようにするために、特定の認証や承認が必要です。
東京エレクトロンデバイスは、医療機器メーカーのお客様へのODMサービスを充実させる上でさまざまなライセンスを取得しており、医療機器の開発・製造において不可欠な認証に焦点を当てます。
本特集記事では、医療機器に求められる各種認証の重要性や取得プロセスについて詳しくご紹介いたします。医療分野における安全性と品質確保のために必須となる認証の理解が、製品の市場導入において不可欠です。
医療機器に必要な許認可
日本で医療機器を開発、製造、販売するためには、医療機器を取り扱うための事業者のライセンス、製品のライセンスを得る必要があります。
| 事業者/事業所ライセンス | 説明 |
|---|---|
| 製造販売業許可 | 都道府県が審査し、医療機器を取り扱う条件を条件を満たした事業所に与える |
| 販売・貸与業許可 | |
| 修理業許可 | |
| 製造業登録許可 | 医療機器の製造を行うことを都道府県に登録する。登録することで医療機器の製造が行える |
| 製品のライセンス | 説明 |
|---|---|
| 製造販売承認書 | 厚生労働大臣、第三者認証機関によりその製造物を審査し、その結果、安全性、有効性が認められた製造物に与えられる |
| 製造販売認証書 | |
| 製造販売届 | リスクの低い製品は製造販売業許可を受けた事業者が届け出を行うことで製造販売が行える |
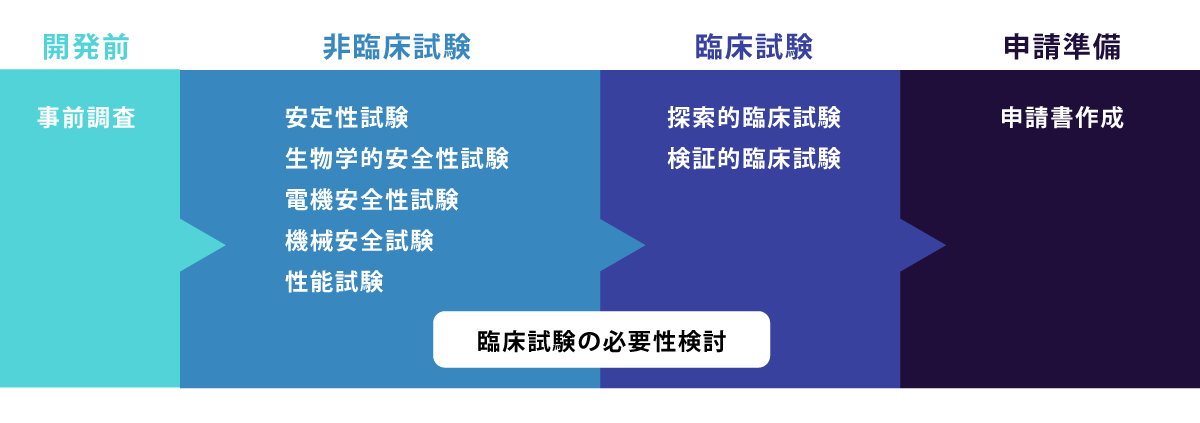
特に製品のライセンスを得るためには、医療機器としての安全性や有効性を認めてもらうために多くの試験を行う必要があります。
医療機器の種類と分類
医療機器は、それらの機器が持つリスクや規制の程度に基づいてクラス分類されています。
そのクラス分類は多くの国や地域で法的な要件や規制基準に結び付いており、それに基づいて機器の製造、販売、および使用に関するプロセスが異なります。国や地域によってクラス分類の基準は異なることがありますが、以下は一般的な分類の一例です。
医療機器メーカーは、各国の規制当局の要件に基づいて製品を分類し、それに従って審査や認証プロセスを進める必要があります。
| 薬事法の分類 | 一般医療機器 | 管理医療機器 | 高度管理医療機器 | |
|---|---|---|---|---|
| 国際分類 | クラスⅠ | クラスⅡ | クラスⅢ | クラスⅣ |
| リスク分類 | 人体へのリスクが極めて低いもの | 人体へのリスクが比較的低いもの | 人体へのリスクが比較的高いもの | 生命の危険に直結する恐れがあるもの |
| 具体例 | 体外診断用機器 | MRI,内視鏡、超音波診断装置 | 人工呼吸器、透析器 | ペースメーカ、人工心臓 |
| 規制 | 届出 (提出先はPMDA) |
第三者認証機関で認証 (基準あり、基準適合の場合) PMDAで承認 (基準はずれ・基準なしの場合) |
第三者認証機関で認証 (基準あり、基準適合の場合) PMDAで承認 |
PMDAで承認 |
| TED対応範囲 | 基板製品、装置本体など | 基板製品、装置本体など | 基板製品など※要相談 | 基板製品など※要相談 |
各国の認証機関
日本では厚生労働省並びにPMDAでの薬事審査を経て販売に進みますが、海外での販売を行う場合は各国での承認が必要になります。
| 国・地域 | 医療機器審査機関 |
|---|---|
| 米国(USA) | FDA |
| 欧州(EU) | MDR |
| ASEAN | AMDD |
| 中国 | NMPA |
| 韓国 | MFDS |
| ブラジル | ANVISA |
| インド | CDSCO |
| その他 | 各国の許可 |
東京エレクトロンデバイスの認証、ライセンス取得状況
東京エレクトロンデバイスでは現在以下のライセンスを得て医療機器のODMサービスを充実させるための体制を整えています。
| 第二種医療機器製造販売業許可 | 東京エレクトロン デバイス株式会社 本社 許可番号 第13B2X10611号 |
|---|---|
| 医療機器製造業登録(設計) | 東京エレクトロン デバイス株式会社 エンジニアリングセンター 登録番号 第14BZ200368号 |
| 医療機器製造業登録 (主たる製造工程、国内における最終製品の保管) |
東京エレクトロン デバイス長崎株式会社 登録番号 第42BZ200017号 |
| 高度管理医療機器等販売業・貸与業認可 | 東京エレクトロン デバイス株式会社 本社 許可番号 第6渋健生薬第1006号 |
| 高度管理医療機器等販売業・貸与業認可 | 東京エレクトロン デバイス株式会社 エンジニアリングセンター 許可番号 第111280220号 |
まとめ
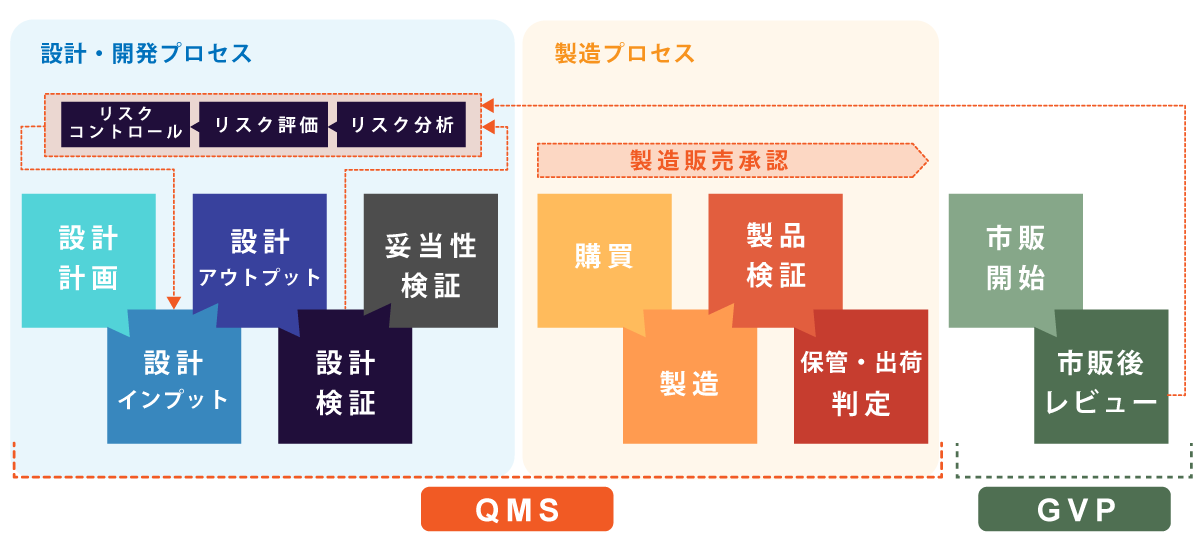
医療機器は設計から量産(QMS)、販売後(GVP)まで品質を担保していく必要があります。
東京エレクトロンデバイスでは、医療機器メーカーのお客様に対してこれらのサポートができるよう、今後も継続して医療機器に関する認証取得への取り組みを進めていきます。
- PMDAとは
- Pharmaceuticals and Medical Devices Agencyの略で、独立行政法人医薬品医療機器総合機構のこと。
- FDAとは
- Food and Drug Administrationの略で、アメリカ食品医薬品局のこと。
- MDRとは
- Medical Device Regulationの略で、欧州医療機器規則のこと。
- AMDDとは
- ASEAN Medical Device Directiveの略で、ASEAN医療機器指令のこと。
- NMPAとは
- China National Medical Products Administrationの略で、中国国家薬品監督管理局のこと。
- MFDSとは
- Ministry of Food and Drug Safetyの略で、韓国食品医薬品安全処欧州医療機器規則のこと。
- ANVISAとは
- Agência Nacional de Vigilância Sanitáriaの略で、ブラジル国家衛生監督庁のこと。
- CDSCOとは
- Central Drugs Standard Control Organizationの略で、インド中央医薬品基準管理機構のこと。
- QMSとは
- Quality Management Systemの略で、品質管理システムのこと。
- GVPとは
- Good Vigilance Practiceの略で、製造販売後安全管理の基準のこと。